Imagen a microscopio electrónico de barrido del patógeno Pseudomonas aeruginosa (falso color)
Fíjate qué curioso. Cuando una bacteria patógena alcanza un organismo donde puede generar una enfermedad, no necesariamente empieza a producir sus toxinas inmediatamente. Durante un tiempo, se dedica a captar nutrientes y replicarse, pues, como es sabido, lo que mejor se le da a las bacterias es hacer copias de sí mismas. No es necesario nada más que una sola célula bacteriana puesta en un cultivo adecuado para tener, al cabo de un par de horas, varios miles de millones idénticas. Cuando estas bacterias están en una cantidad considerablemente grande para ellas, llega el momento en que empiezan a atacar al organismo produciendo la toxina a la vez. ¿Qué sentido tendría que una sola célula gastase su energía en producir unas pocas moléculas de toxina en una cantidad tan pequeña que sería insignificante? Es mejor esperarse a ser muchas iguales para que, aunque cada una produzca un poco de sustancia dañina, al final la cantidad sea suficiente para ser efectiva. Este fenómeno es precisamente lo que conocemos como quorum sensing, o sensación de quórum, primeramente reportado a finales de los años 70 pero que apenas ha empezado a comprenderse más finamente en la pasada década hasta llegar a nuestros días como campo de investigación en activo.
No podemos pasar por alto que las bacterias no sólo no tienen ojos para contarse, sino que tampoco tienen cerebro. ¿Cómo se cuentan unas a otras? ¿Qué implicaciones tiene esto para la medicina y la ciencia en general?
No hace falta tener cerebro para trabajar en equipo
Como son unicelulares y ni siquiera tienen núcleo, como muy pocos otros compartimentos internos, las bacterias presentan al ojo una simplicidad engañosa. Solemos pasar por alto que las bacterias son suficientemente eficaces como para que una sola célula sea capaz de realizar todas las funciones biológicas de nutrición, reproducción y la gran olvidada relación. Podríamos, incluso, plantearnos el significado de la muerte para las bacterias, ya que si dejamos una célula bacteriana tranquilamente en un medio de cultivo, ésta se multiplicará hasta el infinito mientras tenga nutrientes de sobra y el medio esté en condiciones adecuadas sin toxinas, desechos, mala temperatura y niveles de agua, etc. Vamos: que una bacteria bien cuidada es indefinidamente inmortal. Tampoco tienen hijas: las bacterias se parten por la mitad y de ahí la bacteria original podríamos entender que desaparece o que se ha duplicado para hacer dos bacterias nuevas que son pues… la misma. En definitiva, la forma de vida bacteriana nos es demasiado ajena como para que podamos aplicar los mismos principios que usamos en nuestra lógica diaria sobre cómo funciona nuestra biología. Precisamente por eso, la función de relación en las bacterias ha quedado a menudo en un segundo, tercer o cuarto plano a la hora de entenderlas, incluso sabiendo que existe. Y en realidad, no tiene sentido prescindir de esta función: si las bacterias son tan exitosas en cuanto a diversidad, número, cantidad de nichos potenciales, adaptabilidad, etc. en parte se lo deben a su capacidad de coordinarse y hablar entre ellas.

Placa de agar con colonias de V. fischeri brillando en la oscuridad. Wikimedia Commons CC-BY-SA 3.0. – CEB01
Todas las células, incluso las nuestras, hablan entre sí y se mandan todo tipo de mensajes. En el caso de nuestro cuerpo, esto se evidencia en la coordinación que tienen que tener todas las células para mantenerlo formado, sano, con tejidos y órganos funcionales, diferenciados, etc. Pero en el caso de las bacterias siempre nos ha parecido menos evidente, hasta que en 1979 se reportó por primera vez un caso muy llamativo que se considera, a día de hoy, uno de los paradigmas en cuanto a función de relación en bacterias. Se trata de la respuesta bioluminiscente de la especie Vibrio fischeri (también catalogado desde 2007 en el género Aliivibrio), una bacteria Gram negativa que vive prácticamente cultivada en algunos animales marinos, como el calamar hawaiano (Euprymna scalopes) y algunos peces. En esta simbiosis que estos animales establecen con la bacteria V. fischeri, el microorganismo crece y se cuida en unos órganos especiales que emiten luz a partir de las reacciones químicas que las células bacterianas producen. El uso que los animales dan a esta luz va desde el apareamiento y la comunicación con sus iguales hasta atraer presas o asustar depredadores. Sin embargo, la bacteria no le da ningún otro uso que no sea el ser útil y, por tanto, seleccionada por los organismos que requieren producir luz.
Por norma general, producir luz en el mundo de las cosas vivas es siempre un gasto energético importante. La reacción más común nace del sistema luciferina-luciferasa, a la que dedicaremos otro artículo para tratarla con más detalle. Por ello, las bacterias de V. fischeri solo activan la ruta metabólica que emite luz cuando están en un número considerable. Una sola célula luminosa no vale de nada siendo microscópica, pero miles de millones de bacterias generando luz al mismo tiempo ya es otra cosa. Y cuando los investigadores estudiaron, en la década de los 60, este efecto en el laboratorio, primero sugirieron que se debía a que el medio de cultivo contenía un inhibidor desconocido de la bioluminiscencia que se neutralizaba cuando la población bacteriana era suficientemente grande. En los 70, sin embargo, se descubrió que, en realidad, la bioluminiscencia no dependía de un inhibidor, sino de la acumulación de una sustancia activadora que dependía directamente del número de bacterias que había juntas en un mismo lugar. Así es como hablaban las bacterias de V. fischeri para contarse: no necesitaban cerebro para saber cuántas eran, sino que les bastaba con tener receptores para valorar la cantidad de esa sustancia que cada una liberaba y que, cuando sobrepasaba un cierto umbral de concentración, disparaba la señal para expresar el sistema productor de luz. Sería en 1994, en los trabajos de Fuqua, Winans y Greenberg, cuando este fenómeno recibiría el nombre de “quorum sensing”.
Un “wassap” por el grupo
Cuando se destapó el pastel de que las bacterias cuchicheaban entre ellas midiendo la cantidad de tal o cual cosa en el medio donde crecían, te puedes imaginar el interés que se despertó para empezar a caracterizar esos sistemas de regulación. Pronto se descubrió que no era una cosa del V. fischeri, sino que estaba ampliamente extendido y que, además, presentaba un un cierto patrón entre los distintos grupos bacterianos. En todos los casos, el sistema se basa en la producción y liberación de pequeñas moléculas señalizadoras cuya concentración en el medio donde crecen las bacterias es indicativo del número de células que hay, desencadenándose la expresión de una cierta respuesta cuando se supera un cierto umbral o censo mínimo.
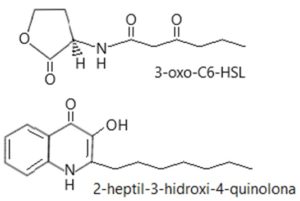
Ejemplos de moléculas señal en quorum sensing. Arriba, la acil-homoserín-lactona que determina la respuesta bioluminiscente en V. fischeri. Abajo, una molécula usada como autoinductor por P. aeruginosa para la formación de su biopelícula
La molécula señal en el mecanismo de quórum de V. fischeri fue aislada y caracterizada por primera vez en 1981 por Eberhard y su equipo. Éstos lo identificaron como N-3-oxohexaoil-homoserín lactona, dentro del grupo de las acil-homoserín lactonas (AHL). En la década de 1990, varios equipos de investigación descubrieron otros muchos microorganismos con un sistema de quórum similar. Entre ellos, debemos destacar a la temible Pseudomonas aeruginosa, una especie que frecuenta las aguas estancadas y el suelo y que vive como oportunista en muchas plantas y animales. Causa numerosas infecciones (especialmente en pacientes con “las defensas bajas”) y es una de las complicaciones más graves para otras enfermedades como la fibrosis quística. Además, cada vez hay menos antibióticos que puedan con ella, porque genera con facilidad individuos resistentes (en parte, debido al mal uso que hacemos de los medicamentos y de lo común que es esta bacteria). De forma independiente por distintos laboratorios, se descubrió que producción de sus factores de virulencia (elastasa, ramnolípidos, hemolisinas, etc.) responde a la percepción de quórum a través de AHLs.
Se estima que el 10% de las bacterias marinas y que hasta el 60% de bacterias del suelo tienen genes para producir AHLs, pero no sólo éstas pueden funcionar como señalizadores.Hay tantos tipos de moléculas que pueden funcionar como molécula señal (oligopéptidos, diésteres furanosil-boratos, butirolactonas, proteínas…) y tantos ejemplos de fenómenos de quórum que nos resulta imposible nombrarlos todos. La formación de esporas en Bacillus y Clostridium, la producción de antibióticos por Streptomyces, la autoagregación de algunas cepas de Escherichia coli… No se ha encontrado, a día de hoy, ninguna bacteria que no presente ningún tipo de mecanismo de comunicación con sus compañeras y vecinas y los fenómenos de quorum parecen implicados en una cantidad de procesos enorme y, sobre todo, de vital importancia en lo que a cooperación y supervivencia se refiere.
Los comportamientos cooperativos son fundamentales en la defensa colectiva frente a antagonistas comunes, que es precisamente la razón por la que muchas especies generan biopelículas, comunidades microbianas donde distintas bacterias se embeben en una malla de polímeros fabricados por ellas mismas que las protegen. A este respecto, la más popular es la placa dental, que basta con pasarte la uña sobre los dientes para poder tomar una muestra. Sin embargo, muchos patógenos (entre ellos, nuestra ya conocida P. aeruginosa) basan su efectividad no sólo en la producción de toxinas, sino también en la formación de biopelículas en distintos tejidos e, incluso, en material hospitalario como los catéteres. Esto explica por qué muchos antibióticos son efectivos en los ensayos de laboratorio, pero luego su efectividad es mucho más reducida al ser aplicados en los pacientes. También estos procesos son necesarios para una proliferación más eficiente gracias al reparto del trabajo, pues dentro de una colonia o población de bacterias es posible que se diferencien ciertos subtipos especializados en alguna actividad metabólica, como los heterocistes de las cianobacterias. Igualmente, dentro de las biopelículas siempre hay algunas células que pueden permanecer en estado durmiente o generar esporas de resistencia, para garantizar siempre que aunque las bacterias maduras sean eliminadas, la población pueda volver a formarse.

El alga D. pulchra
Se ha descubierto que el alga roja Delisea pulchra no está recubierta por la típica biopelícula bacteriana resbaladiza que suele encontrarse sobre las algas marinas. Estudiándola más a fondo, se ha visto que esta especie presenta un mecanismo de intercepción de la señal al producir moléculas (furanonas) que se parecen mucho a las AHL pero que no tienen capacidad activadora de la señal, sino que estropean los receptores de las verdaderas AHL.
Este hallazgo ha dado lugar a lo que hemos pasado a denominar quorum quenching, el bloqueo de la sensación de quórum y, por tanto, de la formación de biopelículas. Se ha visto, asimismo, que existen enzimas específicas (lactonasas) que pueden degradar las AHL que usan otras especies bacterianas para comunicarse, lo que podría representar un mecanismo que tienen las distintas bacterias para hacerle la puñeta a sus competidoras. Si combinamos este hecho con lo crucial que es para la medicina el control de la formación de biopelículas y la liberación de factores de virulencia, hay gran negocio en desarrollar fármacos que interfieran los mensajes que se mandan las bacterias y bloquear su sensación de quórum degradando o secuestrando las moléculas señal, inhibiendo las enzimas que las producen o generando análogos a dichas moléculas que no funcionen. Sabemos, por ejemplo, que algunos fármacos como la claritromicina o algunos quelantes de hierro impiden la formación de las biopelículas en Pseudomonas y el ácido lingbioico interfiere en su percepción de quórum. De momento no tenemos más que unas pocas herramientas en pañales, pero la investigación trabaja activamente en comprender y aprovechar este secreto bacteriano tan bien guardado hasta ahora. Tiempo al tiempo.
FUENTES Y REFERENCIAS
- NEALSON, K.H.; HASTINGS, J.W. (1979) Bacterial bioluminescence: its control and ecological significance. Microbiology Reviews, 43. pp: 496–518 | PMCID: PMC281490. PMID: 396467
- EBERHARD, A.; BURLINGAME, A.L.; EBERHARD, C.; KENYON, G.L.; NEALSON, K.H.; OPPENHEIMER, N.J. (1981) Structural identification of autoinducer of Photobacterium fischeri. Biochemistry, 20. pp 2444-2449 | doi: 10.1021/bi00512a013.
- HENTZER, M.; RIEDEL, K.; RASMUSSEN, T.B.; & amp.; GIVSKOV, M. (2002) Inhibition of quorum sensing in Pseudomonas aeruginosa biofilm bacteria by halogenated furanone compound. Microbiology, 148. pp: 87-102 | https://doi.org/10.1099/00221287-148-1-87
- MADIGAN; MARTINKO; BENDER; BUCKLEY; STAHL (2015) Brock Biología de los microorganismos. 14ª edición. Pearson Educación


