En la Antigüedad, existió una gran controversia entre los estudiosos de la Física con respecto a la composición esencial de toda la materia que éstos observaban. En este contexto, algunos filósofos de la Antigua Grecia planteaban que cada forma de materia estaba compuesta por partículas que constituían tal sustancia: un trozo de papel podría ser dividido casi incontables veces hasta descomponerse en partículas primordiales de papel; un trozo de hueso estaría conformado por partículas primordiales de hueso; el agua de mar estaría constituida por miles de pequeñas partículas de agua de mar. Tales partículas elementales fueron llamadas “homeomerías” y representaban la idea incipiente de que las cosas materiales estaban compuestas por diminutos ladrillos eternos, idea que evolucionaría más adelante en el concepto de “átomo”. De hecho, la palabra “átomo” fue acuñada igualmente por los filósofos griegos (atribuyéndosele el mérito especialmente a Demócrito y su planteamiento de “¿qué pasaría si a los granos de arena, que proceden de fragmentar las rocas, los sigo fragmentando?”), para designar a las partículas “indivisibles” e “indestructibles” que construían todo lo que vemos.
En la actualidad, sabemos que, efectivamente, la materia que conocemos está constituida por unidades que seguimos llamando átomos. Sin embargo, a diferencia de la concepción original, tenemos evidencias suficientes para poder afirmar que los átomos no pertenecen a un número ilimitado de sustancias: no hay átomos de hueso, de carne, de pelo o de agua. Todas estas sustancias complejas surgen, en realidad, de la combinación de un número determinado de especies químicas puras que conocemos como “elementos químicos”, que recogemos en el modelo de la Tabla Periódica, cada una de las cuales está constituida por un tipo concreto de átomo. Los átomos de los diferentes elementos químicos se combinan entre ellos para dar lugar a todas las sustancias que existen y, además, son los que dan pie a que las reacciones químicas sucedan. Por átomo entendemos, pues, a la unidad más pequeña de materia con identidad propia y que es capaz de participar en una reacción.
Por otro lado, también sabemos hoy que los átomos son divisibles en unidades menores que conocemos, en conjunto, como “partículas subatómicas”. Hay una cantidad considerable de partículas subatómicas y no todas forman parte de la materia, pero en los átomos tenemos una estructura muy definida: un núcleo constituido por un conglomerado de partículas con carga positiva (protones) y carga neutra (neutrones) en número variable y una corteza de partículas con carga negativa (electrones). Las cargas positivas compensan a las cargas negativas, de manera que, en los átomos neutros, lo normal es que haya el mismo número de protones que de electrones.
El número de protones viene dado por el “número atómico”, que identifica al elemento químico que sea. Por ejemplo: el átomo con un protón en su núcleo es del elemento “hidrógeno”; el átomo con dos protones, de “helio”; el átomo de tres protones, de “litio”, etc. En la Tabla Periódica, los elementos están ordenados de menor a mayor en función de su número atómico (Z). Por otro lado, el número másico (A) representa el número de protones y de neutrones, que son los que concentran la mayor parte de la masa del átomo. Sin embargo, el número másico de un elemento puede variar, de manera que cada elemento tiene varias versiones de sí, lo que conocemos como isótopos. En los isótopos, varía el número de neutrones, que cambian la masa del átomo; así, muchos isótopos son inestables y se descomponen con el paso del tiempo, lo que causa la “radioactividad”.
Este conocimiento ha sido resultado de la acumulación progresiva, a lo largo del siglo XIX y XX, de evidencias experimentales que han ido mejorando los modelos atómicos que se han ido desarrollando a partir de la concepción original del átomo. El modelo de Thompson concebía el átomo como una esfera maciza de carga positiva con los electrones engarzados en ella. Fue el primer modelo que asoció las cargas eléctricas al átomo; el anterior, el de Dalton, no lo contemplaba. Sin embargo, con los experimentos de Rutherford, se vio que el átomo era en su mayoría espacio vacío, con las cargas positivas en un núcleo rodeado de una corteza de electrones. Bohr definió que estos electrones se distribuían en diferentes niveles de energía, basándose en los espectros atómicos. Con el desarrollo, en el siglo XX, de la teoría cuántica, el modelo del átomo de Bohr fue modificado hasta el modelo actual, el modelo mecanocuántico, influenciado por las aportaciones de científicos como Sommerfield, Schrödinger, De Broglie o Planck.
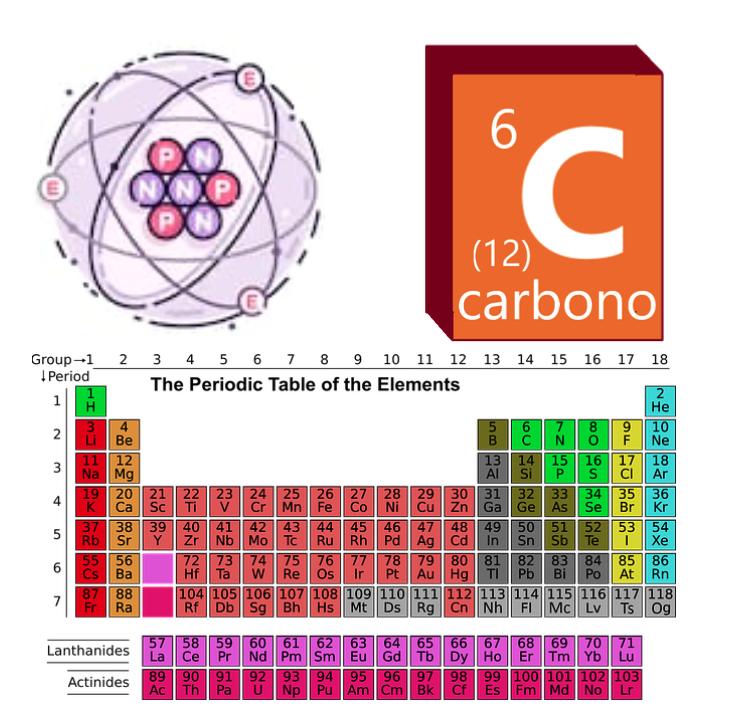
Los átomos no son como se los suele representar, pero realmente no tenemos muchas maneras mejores de dibujarlos de manera comprensible. Por eso, solemos adoptar modelos didácticos sencillos como el modelo de Rutherford o el modelo de Bohr, donde podemos visualizar fácilmente que los átomos se constituyen de un número de protones, neutrones y electrones de forma intuitiva. En la Tabla Periódica, los átomos se ordenan de acuerdo a su número atómico (Z). El número másico puede cambiar. El carbono, por ejemplo, tiene Z=6 y un número másico variable. El isótopo más común es el carbono-12 (A=12), pero también hay otros isótopos muy comunes, como el carbono-14 (A=14), que se desintegra radioactivamente con cierta facilidad y se usa para datar restos arqueológicos.
 Proyecto Dodociencia es un proyecto por Hidden Nature está bajo licencia internacional Creative Commons Reconocimiento - No Comercial - CompartirIgual 4.0. Creado bajo el proyecto Hidden Nature. Puede encontrar permisos adicionales de los concedidos con esta licencia en nuestras políticas de privacidad
Proyecto Dodociencia es un proyecto por Hidden Nature está bajo licencia internacional Creative Commons Reconocimiento - No Comercial - CompartirIgual 4.0. Creado bajo el proyecto Hidden Nature. Puede encontrar permisos adicionales de los concedidos con esta licencia en nuestras políticas de privacidad