El concepto de pH lo utilizamos constantemente sin darnos cuenta, pues forma parte de nuestro día a día, por ejemplo, nuestro champú es de pH neutro, hacemos dietas alcalinas, cae lluvia ácida… Neutro, ácido o alcalino, son terminologías relacionadas con el pH. De hecho, en BioDic encontraríamos estas definiciones:
Ácido: Agrio, de sabor de agraz o vinagre, o parecido a el. Cualquiera de las sustancias de sabor agrio, solubles en agua, la cual enrojece la tintura del tornasol. Químicamente considerados, los ácidos contienen hidrógeno y un radical negativo; aquel puede ser reemplazado elementos o radicales positivos para formar sales.
Básico: Perteneciente o relativo a la base o bases sobre que se sustenta algo, fundamental. En química, se aplica a la sustancia que tiene la propiedad de combinarse con los ácidos para formar sales.
Neutro: Que no presenta ninguno de dos caracteres opuestos. (…) En química, se refiere al compuestoquímico que no tiene carácter ácido ni básico. Se dice de las moléculas que no se mueven en un campo eléctrico, bien por no poseer carga o por tenerlas compensadas.
Voy a desglosar toda la idea del pH y sus rangos para entenderlo en profundidad, además de ver un análisis histórico para que comprendáis la cantidad de tiempo que le tomó a los científicos entender cómo interaccionaban estas sustancias con nosotros y con el ambiente.
Concepto ácido y básico como rangos del pH
Antes de entrar en el concepto de pH per se, debemos comprender el significado de ácido y de base. La palabra ácido viene del latín “acidus” y se refiere al característico olor y sabor que tienen estas sustancias. Este término fue acuñado en 1.661 por el prestigioso químico inglés y padre de la química moderna, Robert Boyle, que resumió las propiedades fundamentales de las sustancias ácidas con estas características:
- Poseen sabor ácido
- Son corrosivos
- Cambian el papel tornasol a tonos rojizos
Por otro lado, a las sustancias alcalinas las definió como sustancias capaces de consumir o disminuir las capacidades de los ácidos, revirtiendo sus efectos al combinarse. Pero el concepto de sustancia alcalina encontraba pronto sus limitaciones, pues se consideraban alcalinos a hidróxidos metálicos solubles – como el de litio, sodio, potasio… – y desconsiderando a sustancias no metálicas, como el NH3. Hasta la mitad del siglo XVIII, el término “base” o “básico” no existía, ya que fue Guillaume-François Rouelle el primero que lo acuñó para definir una sustancia que servía de base para contrarrestar a los ácidos y formar sales; proceso que Gay-Lussac denominó “neutralización” en 1.814.
Teoría Iónica de Arrhenius
Hasta este punto, la idea de ácido y base es más que nada anecdótica, porque no fue hasta 1.884 que el científico nobel Arrhenius les dió una definición más cercana a la que hoy día se usa. Arrhenius desarrolló la Teoría Iónica, en la cual afirmaba que los compuestos se disocian en el agua a modo de complejos cargados, a los que denominó iones. Para verlo más fácil, pongamos el ejemplo de la sal disuelta en agua:
| H2O | ||
| NaCl(s) | → | Na+(aq) + Cl–(aq) |
Amplió este concepto años más tarde, explicando que los ácidos son sustancias que se ionizan al disolverse en agua liberando un ión hidrógeno (H+) y un ión negativo correspondiente al resto de la sustancia, como en el caso del ácido clorhídrico (HCl) aquí mostrado.
| H2O | ||
| HCl(g) | → | H+(aq) + Cl–(aq) |
Las bases quedaban definidas como sustancias que liberan un hidróxido (OH–) al disolverse y una sustancia cargada positivamente, como se observa con el hidróxido de sodio (NaOH).
| H2O | ||
| NaOH(s) | → | Na+(aq) + OH–(aq) |
Con esta teoría consiguió explicar por qué se daba la neutralización de un ácido y una base, dado iones H+ y OH–, que son los que aportaban ese carácter ácido o básico, reaccionaban dando lugar a una molécula de agua. Pese a todo, su Teoría Iónica no era capaz de explicar todos los sucesos y circunstancias:
- Sólo se aplicaba a reacciones que ocurren en el seno del agua.
- No explica por qué compuestos con hidrógeno como el HCl liberaban el hidrógeno y otros compuestos como el metano (CH4) no lo liberaban.
- Sólo consideraba bases aquellas que tenían hidróxidos, pero no sabía explicar por qué habían compuestos con el mismo comportamiento y sin hidróxido, como el NH3 o el carbonato de sodio (Na2CO3).
Definición matemática del pH y la Teoría de Bronsted-Lowry
Antes de seguir profundizando en el conocimiento del pH, tenemos que desviarnos para conocer unos cuantos conceptos relacionados que nos servirán para entender mejor lo que vendrá a continuación. Empezaré analizando a la molécula de agua. Su fórmula no es ningún misterio, casi todos la reconocemos por H2O; pero la realidad es que no toda el agua está compuesta de moléculas con esta estructura.
El agua conduce la electricidad, ¿cierto? Pues esto no sería posible sin la presencia de iones en su seno. Y, si bien en un agua que bebemos sería lógico pensar que existen iones de diferentes sustancias que pudieran actuar conductores (por las sales que lleva disuelta), lo cierto es que incluso en agua pura también posee una mínima capacidad de conducción. Esto se debe al fenómeno conocido como autoionización del agua.
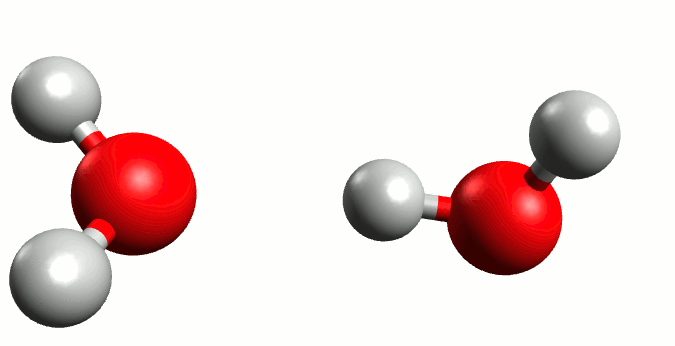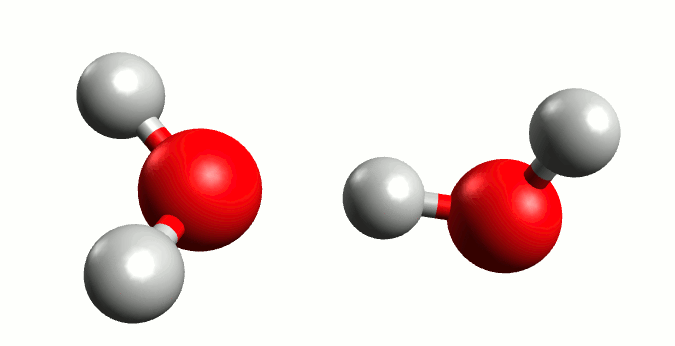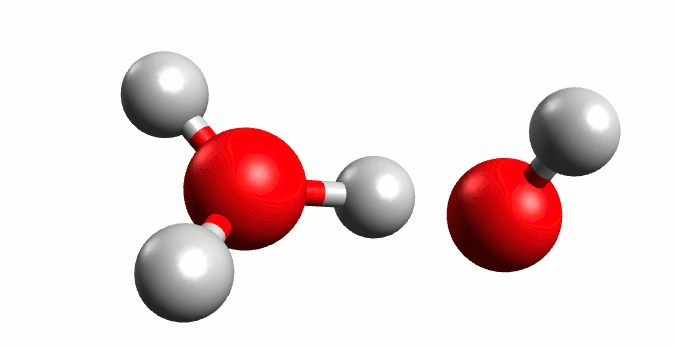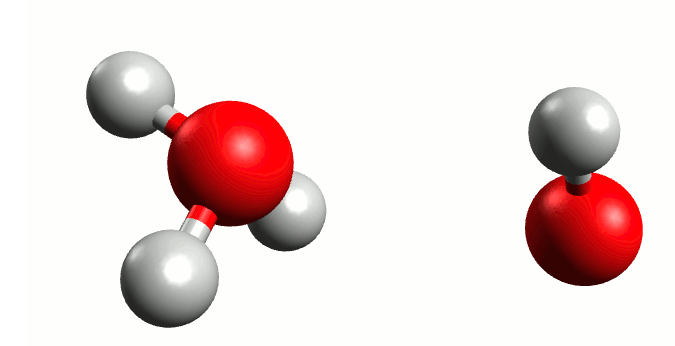
Representación gráfica de la autoionización del agua. Animación por Manuel Almagro Rivas
El agua se compone de 2 átomos de hidrógeno y uno de oxígeno que comparten electrones para alcanzar la Regla del Octeto, que, a grosso modo es la configuración electrónica que “buscan” adquirir los elementos con el fin de aumentar su estabilidad – ver artículo sobre la Regla del Octeto. Pero, pese a que los hidrógenos comparten sus iones, la molécula de oxígeno es más “fuerte”, por lo que los electrones estarán más cerca de ella que de los hidrógenos, creando así una carga parcial negativa (δ– ) en la molécula de oxígeno proveniente de tener estos electrones tan cerca; y una carga parcial positiva (δ+) en los hidrógenos por tenerlos más alejados. En esta circunstancia se dice que la molécula de oxígeno es más electronegativa que los hidrógenos.

El sodio tenderá a perder un electrón y el cloro a ganarlo para alcanzar el octeto. Animación por: Víctor Pérez Asuaje
Pero hay circunstancias que ocurren con una probabilidad muy baja, donde el oxígeno “tira” tanto del electrón del hidrógeno que se lo lleva, liberándose el hidrógeno a modo de ión positivo o catión (H+) y quedándose un ión negativo o anión hidróxido (OH–), y de aquí nace en 1923 la teoría de Bronsted-Lowry. Está demostrado que el hidrógeno sin su electrón es demasiado inestable para existir por si mismo, y tiene una electropositividad tan elevada que se une a la primera molécula de agua que se le cruza, dando lugar a un ión cargado positivamente llamado hidronio (H3O+).
Esta situación es muy inestable, por lo que el hidróxido tiende a recuperar un hidrógeno y el hidronio a liberarlo; generando un equilibrio entre las moléculas de H2O y las de H3O+ y OH–.
| H2O (l) + H2O (l) | ↔ | OH– (aq) + H3O+ (aq) |
Este equilibrio se describió mediante la constante de equilibrio: Keq = [H+][OH–], cuya experimentación demostró que a 25 ºC la constante Keq= 10^-14. Con un poco de matemáticas básicas podemos entonces observar que, dada la misma probabilidad de liberar el protón y de aceptar el protón de hidrógeno, [H+]=[OH–]=10^-7 molar. Desde este punto, si la concentración de hidróxidos es superior a la de hidronios se afirma que el pH de dicha solución es ácida y, si la de hidronios es superior, el pH es básico.
De aquí nació el concepto de pH, que son las siglas de potencial de Hidrogeniones y se define como el antilogaritmo de la concentración de protones {pH = – log([H+])}. Definición que proviene del desarrollo de la fórmula anterior al aplicar logaritmos a todos sus términos, quedando como:
log (Keq) = log ([H+]) + log ([OH–])
log (10^-14) = log ([H+]) + log ([OH–])
14 = – log ([H+]) – log ([OH–])
14 = pH + pOH
Así conseguimos relacionar directamente los valores del pH y del pOH. Quedando una ecuación así: pH + pOH = 14; donde el pH neutro corresponde con la mitad, pH= 7. Por encima de este valor es básico y por debajo es ácido. Así pues, la teoría propuesta por Bronsted y Lowry define al ácido como toda sustancia capaz de donar un protón y base como toda sustancia capaz de aceptar un protón, eliminando al oxígeno de la ecuación, que era una de las limitaciones de la teoría de Arrhenius.
Así pues, como se observa con el agua, las sustancias en disolución tienen tendencia a formar pares ácido-base en una situación de equilibrio. El equilibrio de una reacción puede verse influido por factores externos para tener más tendencia a que se dé en una dirección o la otra. Pondré esta idea de una forma más sencilla, si calentamos agua y vamos echando sal hasta que no se disuelva más sabremos que la reacción será:
| H2O | ||
| NaCl(s) | → | Na+(aq) + Cl–(aq) |
Donde podemos apreciar la cantidad de sustancia que el agua puede mantener en su seno a esa temperatura, llegando a un punto donde comienza a precipitar la sal, llamado punto de saturación. A medida que se va enfriando el líquido, parte de la sal que estaba disuelta volverá a precipitar, pues el enfriamiento del agua hace que la tendencia de la reacción cambie de estar separada en iones a estar en forma de sólido; o dicho de otro modo, que su punto de saturación disminuya.
| H2O | ||
| NaCl(s) | ← | Na+(aq) + Cl-(aq) |
Esta idea sirve como analogía de lo que le pasa a los pares ácido-base. Ahora lo plantearé partiendo de un ácido débil, el ácido acético:
| CH3COOH + H2O
(ácido) + (base) |
↔ | CH3COO– (aq) + H3O+ (aq)
(base) + (ácido) |
En este caso, el factor que cambia la tendencia de los reactivos no es la temperatura, sino la propia carga de los mismos. Los reactivos iniciales eran ácido y base, pero al reaccionar, el ácido acético liberó un protón, provocando que el H2O lo aceptase. De esta manera, la tendencia del ácido acético cambia, ya que no libera más protones sino que los acepta, por lo que ha pasado de ser un ácido a convirtirse en una base. Lo mismo pero al revés pasa con el agua y el hidronio. Por eso, CH3COOH con CH3COO- y H2O con H3O+ se denominan pares ácido-base; y, en medio líquido, permanecen en un estado de constante equilibrio, intercambiándose sus funciones constantemente.
¿Qué ocurre si el ácido o la base no es débil?
Al comienzo de la analogía hice hincapié en poner como ejemplo un ácido débil, y eso se debe a que los ácidos fuertes (o por el contrario, las bases fuertes) tienen tendencia a mantener su estado después de la reacción. Por ejemplo, el HCl es un ácido fuerte, pues, aún después de haber perdido su protón, sigue siendo una base más débil que el H2O, por lo que no tenderá a priori a volver a su estado protonado. Así que podemos definir a un ácido fuerte (o base fuerte) como aquella sustancia que no tiende a formar pares ácido-base con el agua o, que su tendencia es permanecer en estado iónico.
Teoría del pH de Lewis
Pese a que la teoría previa resolvía la mayor parte de los problemas que planteaba la de Arrhenius, aún existían dos limitaciones más. Aunque esta teoría cubría prácticamente a todas las bases, existen moléculas que no poseen protones y que actúan experimentalmente como ácidos (SO3, SO2, CO2, BF3, o cationes metálicos); y, las reacciones pueden darse en un seno no acuoso, y aún así presentar comportamiento de ácido-base.
En 1923, el profesor Lewis postuló la más completa de las teorías ácido-base, solucionando las limitaciones hasta ahora habidas. Su teoría se basa en que no es el hidrógeno el que se une o separa a una molécula, sino que los que determinan el comportamiento ácido-básico son los electrones de la capa de valencia de los compuestos o pares no compartidos. De esta manera, una base sería un elemento/compuesto/sustancia que puede donar un par de electrones, y un ácido auqel que los puede aceptar. Para ello, el ácido debe tener su octeto de electrones incompleto, y la base debe tener algún par de electrones solitarios.
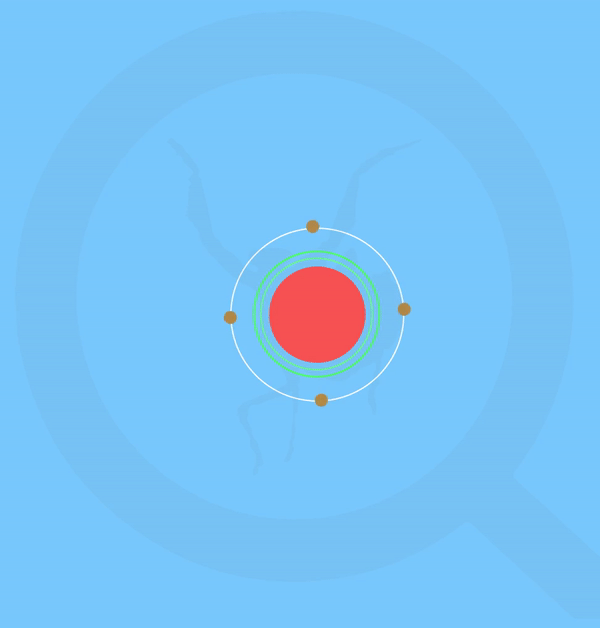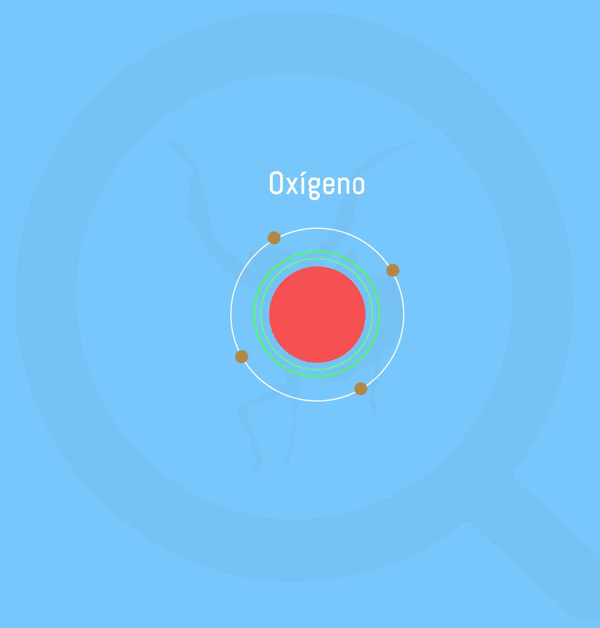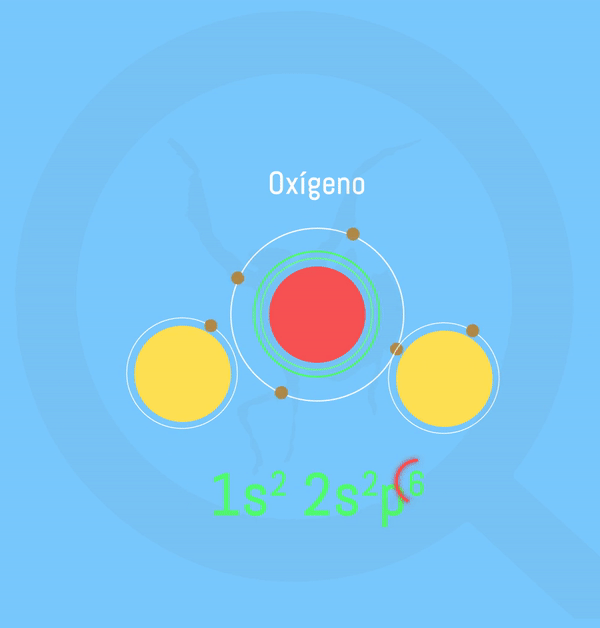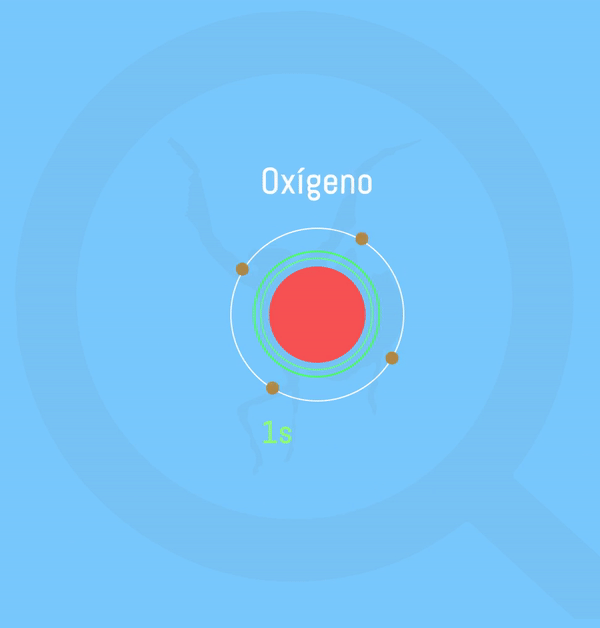
Representación animada de la formación de agua según la teoría de Lewis. Realizado por: Victor Pérez Asuaje
Cuanto más cerca estuviera el elemento o compuesto de alcanzar el octeto, más ácido sería, pues mayor sería su tendencia a captar electrones. Por el contrario, cuantos menos electrones tuviera en su capa de valencia, más tendencia tendría a “deshacerse” de él y alcanzar el octeto. Recuerdo al lector que el octeto es el estatus de equilibrio deseado por los elementos y los compuestos debido a que le confiere estabilidad. Por tanto, teóricamente, cualquier molécula con un par de electrones que no estén implicados en la unión con otro átomo y bajo condiciones determinadas, pueden formar un enlace.
Veámoslo usando la molécula de agua que usamos para Bronsted y Lowry. En el H2O, el oxígeno tiene 4 electrones no compartidos y 2 electrones compartidos, cada uno con un hidrógeno. Alcanzado el octeto, es poco probable que reaccione con otras moléculas a causa de la propia estabilidad de la molécula, pero como está polarizada parcialmente por su electronegatividad, atrae protones parcialmente positivos de otras moléculas de agua. Así pues, si una molécula de oxígeno está demasiado polarizada, su hidrógeno puede tener tan lejos a sus electrones que puede acabar interaccionando con otra molécula de oxígeno y formando un enlace con el mismo, separándose de su oxígeno original y, explicando de esta manera la autoionización del agua. Pero como se dijo al comienzo de este parrafo, la estabilidad conferida por el octeto hace que esta circunstancia ocurra poco.
Pero es gracias a esta carga parcial que existe la vida en la tierra, sin este pequeño detalle en la molécula de agua, no existiría esa interacción entre moléculas de H2O conocidas como puentes de hidrógeno. Y es gracias a estos puentes de hidrógeno que el agua es lo suficientemente estable como para permanecer en estado líquido a la temperatura media terrestre.
Resumen breve de la teoría del pH
Hagamos una pequeña síntesis de lo visto para recordar todo bien:
- Boyle dió pie a las denominaciones ácido y alcalino, así como una breve y muy incompleta explicación.
- Arrhenius postuló su teoría de los iones, aportando la primera definición química de ácido y base; pero las bases sólo podían ser hidróxidos.
- Bronsted y Lowry completaron la definición de Arrhenius al añadir que lo que se cedía era un protón de hidrógeno formando pares ácido-base. Además desarrollaron la definición matemática del pH. No supieron responder cómo ocurría cuando el seno no era el agua o no habían hidrógenos en la molécula.
- Lewis aportó la teoría más completa, afirmando que lo que compartían eran pares de electrones, no importaba la presencia-ausencia de protones.
Y aunque en la actualidad la teoría de Lewis es la más completa y aceptada, en disoluciones acuosas aún se usan los principios de Bronsted y Lowry por ser perfectamente válidos y considerablemente más fáciles. Así pues, terminamos la historia de la teoría de ácidos y bases y, su relación con el pH. Si te ha gustado este artículo, podrían interesarte alguna de las siguientes opciones:
- Ver más contenido en nuestro blog
- Ver contenido audiovisual
- Bibliografia1
Notas[+]
Notas ↑1 http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch11/acidbase.php http://undersci.ucc.ie/wp-content/uploads/sites/12/2014/11/Robert_Boyle.pdf
https://www.britannica.com/science/Arrhenius-theory
K.W. Whitten, K.D. Gailey and R.E. Davis, “General Chemistry” (4th edn., Saunders College Publishing 1992)



4 comentarios en “¿Qué es el pH? ¿Cómo se calcula? Evolución del concepto de pH”
Pingback: ¿Qué son los aditivos alimentarios? Lista de aditivos para la comida
Pingback: Muelas del juicio... ¿un vestigio de la evolución? - Hidden Nature
Pingback: El pH ácido, punto débil de las células cancerosas - Hidden Nature
Pingback: Muelas del juicio… ¿un vestigio de la evolución? – Aprendamos Ingeniería