Si ha tenido a bien examinar granos de polen al microscopio habrá podido observar que, en su mayoría, más allá de los ornatos con que suelen estar decorados, son unas estructuras esféricas y pequeñas. Para llevar a cabo la fecundación vegetal no hace falta mucho más, aparte de una “fuerza motora” que nos ayude a movernos de un individuo a otro genéticamente compatible, por supuesto.
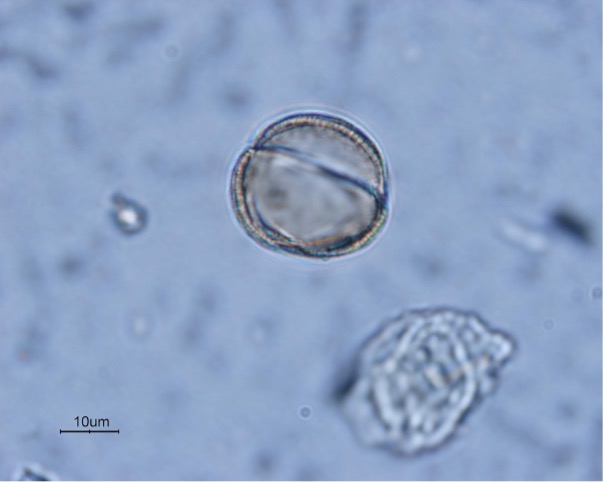
Grano de polen de Prunus cerasifera. A diferencia de los granos de polen de las especies terrestres, polinizadas por insectos o el viento, que muestran perfiles más o menos esféricos, los granos de polen de las especies hidrófilas son aplanados (discoidales) o en forma de bastoncillos. Éstos se agregan forman estructuras más o menos filamentosas que facilitan la posibilidad de fecundación. Imagen tomada de la base de datos Global Pollen Project.
Sin embargo, no todas las plantas muestran granos de polen esféricos. Por ejemplo, algunas especies de Zostera o Cymodocea (como C. nodosa) producen un grano de polen alargado y filiforme, como si fuese una especie de gusano o anguililla la que estuviese a cargo de posibilitar la reproducción. El hecho de que Zostera produzca un grano de polen de estas características responde a dos cuestiones: 1) el agua disgrega los granos de polen, convirtiéndolos en un material genético inservible y desaprovechado, pues no tiene forma de llegar a su destino (el óvulo femenino) y 2) los sistemas de polinización hidrófila (como el de Zostera) no han adaptado esta morfología por mero capricho.
Antes de entrar en materia, me gustaría advertir de un hecho: no debemos confundir la polinización hidrófila con la reproducción llevada a cabo por plantas acuáticas carentes de estructuras florales, como puede ser el caso de las algas. Por supuesto, tampoco se parece a la polinización terrestre o a la que muestran otras especies acuáticas que desarrollan sus flores por encima de la lámina de agua y tiene como vectores a insectos o el propio viento. ¿Por qué digo esto? Pues porque en ocasiones se cita como ejemplo de polinización acuática el caso de Vallisneria descrito por Erasmus Darwin, abuelo de Charles Darwin.
La Vallisneria de la que nos hablaba Erasmus era una planta de agua dulce que “libera” sus flores, las cuales ascienden por la columna de agua unos pocos centímetros hasta llegar a la superficie, donde se abren. Una vez en la superficie, los pétalos de la flor masculina se recurvan y crean sobre la superficie líquida un menisco que permita que la brisa más ligera mueva la flor hasta encontrarse con su complementaria femenina, que está anclada a través de un largo pedúnculo al fondo de la masa de agua. Cuando la flor masculina cae dentro de la “depresión” originada por la flor femenina, ambas se tocan y es en ese preciso instante donde se produce la transferencia polínica. Digamos que, en este caso, Vallisneria no libera al medio los granos de polen, sino pequeñas flores masculinas completas. Un fenómeno aún más complejo y que muchos autores no consideran hidropolinización.
Aunque la polinización hidrófila se trata de un tipo de polinización mediada exclusivamente por el líquido elemento. Aunque parezca un mecanismo de polinización extraño o inusual, conocemos 31 géneros diferentes (pertenecientes a 11 familias botánicas) que la muestran. Los individuos que la presentan se distribuyen desde Suecia hasta Argentina y aparecen tanto a nivel del mar como a 5000 metros de altura, donde pueden llegar a entorpecer la navegación a través del lago Titicaca, como es el caso de Elodea potamogeton. Pero, ¿cómo lo hacen?
En primer lugar, para solventar la destrucción que el agua podría causar en los granos de polen, los granos (¿o debería decir filamentos?) se recubren con proteínas, mucílagos y carbohidratos que, además de protegerlos del agua les hacen pegajosos, de tal modo que se adhieren unos a otros para formar unas estructuras que, vistas sobre la superficie del agua, parecen copos de nieve, plumas (como los de la fijiana Halophila ovalis) o finos discos (como los de la australiana Lepilaena cylindrocarpa). Sin embargo, aún queda por responder cómo se “reconocen” o “encuentran” los granos de polen masculinos con las flores femeninas que deben fecundar.
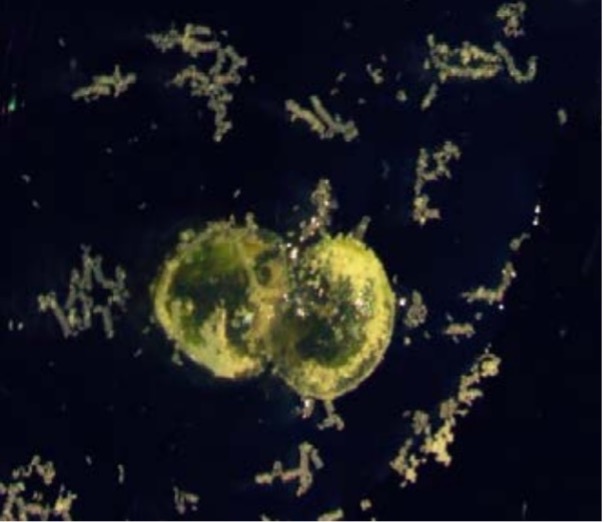
Antera Ruppia. Las anteras de las especies de Ruppia liberan su polen al medio acuático, donde se agregan y forman unas pequeñas marañas que permiten aumentar las posibilidades de éxito reproductivo. Imagen cortesía de Santos Cirujano y Pablo García Murillo.
Esta es una cuestión física y matemática que ya resolvió Bernard Koopman y sus colegas del Grupo de Operaciones de Guerra Antisubmarina de los Estados Unidos durante la II Guerra Mundial. Koopman demostró de manera elegante que si cualquier elemento de rastreo sigue una trayectoria aleatoria en un plano bidimensional, la posibilidad de hacer blanco aumenta rápidamente con la amplitud de la trayectoria seguida, tal y como recogió en la expresión p= 1-e-wL/A, donde p simboliza la probabilidad de alcanzar al objetivo; w es la amplitud de la trayectoria descrita por el objeto de búsqueda (nuestro grano de polen); L señala la longitud de la trayectoria y A corresponde al área barrida en la búsqueda.Dicho de otra forma, si la probabilidad de una polinización en el medio acuático es baja, podemos incrementarla si aumentamos las dimensiones del instrumento de búsqueda y si éstos no siguen trayectorias completamente aleatorias.
¿Pero por qué usar una estrategia de polinización en superficie (2D) y no una subacuática (3D)? Las estrategias de polinización en 3D a priori serían menos eficaces ya que los granos de polen y los estigmas se encuentran dispersos en un volumen, a diferencia de la polinización en superficie, donde polen y estigmas se “concentran” en un plano, el de la propia superficie del agua. Asimismo, las diferencias estocásticas o debidas al azar se incrementan en 3D. En resumen, en un plano, cualquier estigma acabará antes o después por ser alcanzado por un grano de polen. No obstante, la polinización subacuática o tridimensional existe en el mundo vegetal, concretamente en plantas permanentemente sumergidas, como Thalassia testudinum, cuyos granos de polen se encuentran adheridos a una hebra mucilaginosa que se enrollan cuando chocan con los estigmas de la flor femenina, duros e hirsutos. Obviamente, corren el riesgo de quedar enredados en cualquier otra estructura dura e hirsuta que puedan encontrar en su viaje.
Frente a esto, hay especies como Enhalus acoroides, Phyllospadix scouleri o Zostera marina que combinan ambas estrategias, la polinización 3D y 2D, cubriendo de esta manera la posibilidad de reproducirse tanto con marea baja como con marea alta.

Phyllospadix scouleri es una planta marina que se encuentra adherida a rocas en la zona intermareal. Estas plantas han adoptado una estrategia reproductiva mixta, pudiendo liberar su polen tanto con marea baja (2D) como con marea alta (3D), hecho que incrementa su posibilidad de éxito reproductor en un hábitat fluctuante.
Pero claro, estas son sólo algunas de las soluciones que aportan al problema las flores masculinas. ¿Qué aportan las femeninas a la resolución del conflicto de tener que reproducirse en el medio acuático? En primer lugar, los estigmas amplían el área eficaz del blanco y, en segundo lugar (aunque no por ello menos importante) alterando su forma para incrementar la probabilidad de encuentro. Un ejemplo puede ser el de las brácteas de Lepilaena cylindrocarpa, donde los tres estigmas de la flor femenina presentan una bráctea que las mantiene unidas, lo que les da un aspecto de guante de béisbol. Esta “concavidad”, aunque pequeña, crea una depresión en la superficie del agua que aumenta las posibilidad del encuentro reproductor. Asimismo, las flores femeninas oscilan como consecuencia de las corrientes agua, fenómeno que indudablemente también aumenta el área efectiva del objetivo, tal y como ocurre en Ruppia maritima, cuyo pedúnculo hace que las flores se balanceen cual limpiaparabrisas, hecho que permite “recolectar” los granos de polen.
Para finalizar, me veo en la obligación de romper una lanza en favor de las plantas hidrófilas y la hidropolinización pues más allá de llamar nuestra atención, el conocimiento de estas estrategias reproductivas nos deben ayudar a abordar problemas de ecología evolutiva y demografía vegetal, ya que la esperanza de vida del polen hidrófilo dura poco. Por ejemplo, el polen de Zostera tiene una duración media de ocho horas de vida después de su eclosión. Asimismo, las especies hidrófilas podrían ayudarnos a conocer mejor las pautas de colonización geográfica y genética de múltiples poblaciones, puesto que las poblaciones de agua dulce de plantas hidrófilas están reproductivamente aisladas, ya que el polen no puede saltar de un lago o río a otro. Dicho de otro modo, el flujo genético se fundamenta, en última instancia, en la transferencia de frutos o fragmentos vegetativos diseminados.






















