En el mundo hay cosas que suceden solas y otras que no salvo que se invierta un poco de energía en ellas. Los metales, por ejemplo, se oxidan con el paso del tiempo, pero nunca un trozo de hierro oxidado se desoxidará solo. De la misma manera, una taza de café nunca se calentará si no se le añade esa energía desde fuera; es más, tiende a enfriarse. Curiosamente, los principios que explican por qué esto sucede así y no al revés son las mismas que nos dicen por qué nuestras máquinas nunca serán de rendimiento absoluto y perpetuo y nos sugieren cómo podría ser el fin del Universo. Se trata de los postulados básicos de la Termodinámica, la rama de la Física que trata de describir cómo se intercambia y transforma la energía.
En origen, la Termodinámica se centró en el funcionamiento de las máquinas térmicas que alimentaban las locomotoras a vapor. Sin embargo, hoy en día esta disciplina explica muchas cosas más, permitiendo, por ejemplo, predecir cómo va a transcurrir una reacción química en determinadas condiciones o cómo se va a comportar una muestra de tejido biológico que se desea conservar bajo congelación. En nuestra vida cotidiana, de hecho, las leyes de la Termodinámica están funcionando, pues nuestra realidad funciona a base de un flujo constante de energía de unos cuerpos a otros.
La llama emite calor al exterior, calentando los objetos a su alrededor, siguiendo principios de la Termodinámica.
No deja de ser interesante que, pese a lo vital que es y lo estudiada que está, nadie sepa definir de forma totalmente satisfactoria qué es la energía ni de dónde procede en realidad, pues se considera una propiedad intrínseca de la materia que se manifiesta bajo numerosas apariencias. Radiaciones y ondas, vibraciones, movimiento o temperatura son algunas de sus formas principales, pero todas están en constante intercambio y trasvase. Un ejemplo familiar es un coche aparcado en una cuesta: encendido o apagado, éste tiene una cierta susceptibilidad de empezar a moverse hacia abajo por acción de la gravedad (lo que se cuantifica y denomina como “energía potencial gravitatoria”, asociada a la altura). En el momento en el que los frenos fallasen y el coche empezase a perder altura a cambio de ganar velocidad por la aceleración de la gravedad, la energía potencial se convertiría en energía cinética, asociada al movimiento. Por otro lado, cuando el coche está siendo conducido, el motor está convirtiendo la energía química contenida en los hidrocarburos de la gasolina en el movimiento de las ruedas motrices para desplazarse.
En todos los procesos en los que una forma de energía se transforma en otra, sin embargo, cabe señalar que es muy frecuente que parte de ésta se pierda en forma de calor (una forma de energía que no podemos aprovechar). Las fuerzas de rozamiento que actúan sobre los neumáticos por la fricción con el pavimento, en nuestro ejemplo, causan que parte de la energía que se convierte en movimiento no sirva para realizarlo, sino que eleva la temperatura del asfalto y la rueda y, al final, se disipa para siempre. Fue esta una de las razones por las que, a mediados del siglo XIX, nació la Termodinámica: era necesario saber cómo una máquina podría aprovechar al máximo una fuente de energía para realizar un trabajo mecánico al mismo tiempo que se minimizaban las pérdidas en forma de calor.
Pon atención en que calor y temperatura no son lo mismo, físicamente hablando. La temperatura de un cuerpo es una medida de la vibración (o energía cinética) de las partículas que lo componen, mientras que el calor es una sensación que obtenemos cuando esa energía fluye entre nuestros cuerpos y los que nos rodean. Cuando “tenemos calor” lo que sucede es que no estamos intercambiando temperatura adecuadamente con el medio o éste está a mayor temperatura que nosotros: nuestro organismo produce (como animales homeotermos que somos) una cierta cantidad de energía en forma de calor que, en un entorno cálido, se pierde de forma muy lenta, algo que se agrava en condiciones de alta humedad, pues el sudor no se evapora y no se lleva ese calor de nosotros. Asimismo, cuando “tenemos frío” estamos sintiendo cómo perdemos temperatura más rápido de lo que nuestro cuerpo la genera.
Con esto ya podemos entender el primer principio de la Termodinámica, que afirma que la energía de un sistema depende de la diferencia entre las pérdidas y ganancias energéticas en éste: la energía cinética (temperatura) de una taza de café dependerá, en todo momento, de la energía que se le aporta (como cuando, por ejemplo, la metemos en el microondas) y de la energía que se disipa en el aire. Asimismo, si nuestro objeto de estudio es el Universo en sí, cabe entender que toda la energía contenida en él es, en todo momento, la misma (pues suponemos que “no hay nada fuera del Universo” con lo que éste pueda ganar o perder energía). De esta forma, a partir de este principio se deduce que la energía ni se crea ni se destruye, sino que tan sólo se transforma y cambia de un lugar a otro.
Sin embargo, como hemos dicho, parte de esta energía siempre se pierde en forma de calor. A su vez, este flujo siempre toma la misma dirección, de manera que en los sistemas cerrados (que no captan ni liberan energía ni materia con el exterior) la energía acaba degradándose y sus componentes, desordenados. Así, podemos introducir ahora el segundo principio de la termodinámica, que expone que todos los sistemas tienden a estar en el menor grado de organización posible, es decir, permanecer tan desordenados como el sistema permita. La medida de todas las posibilidades que tienen los elementos de un sistema para organizarse viene dada por la “entropía”.
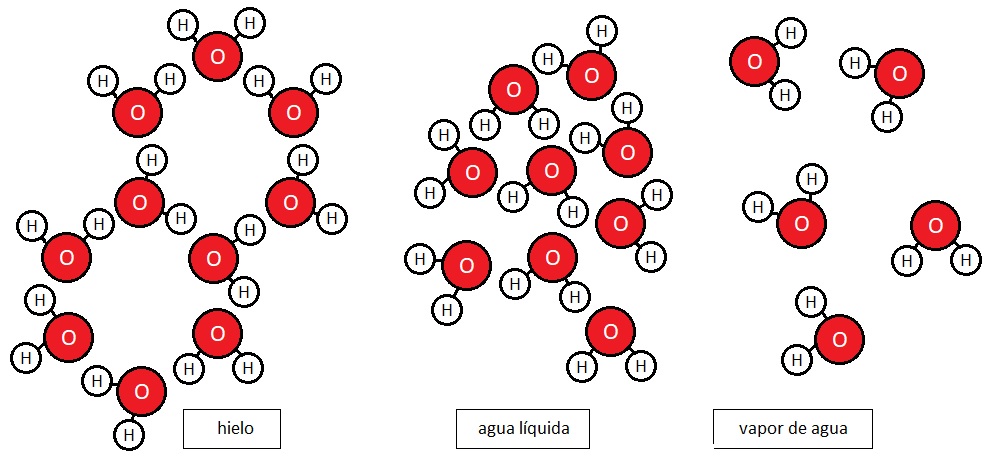
Esquema de las estructuras que forman las moléculas de agua según su estado.
En un cubito de hielo, las moléculas de agua se encuentran espaciadas unas de otras formando redes geométricas definidas, tal que las posibilidades que tienen de ubicarse dentro del cubito de hielo son muy limitadas; las moléculas están muy ordenadas y la entropía es baja. Sin embargo, al tocarlo con nuestras manos calientes, parte de nuestra energía fluye hacia el cubito (de ahí que sintamos frío) y, al aumentar el movimiento de sus partículas, lo desordenamos accidentalmente, pasándolo a estado líquido. En el agua líquida las moléculas tienen libertad para moverse y resbalar unas sobre otras, pudiendo disponerse de muchas maneras distintas; la entropía es mucho mayor y el conjunto está mucho más desordenado. En estado gaseoso, la entropía es todavía más alta, ya que las moléculas de agua evaporada pueden moverse con total libertad y configurarse de incontables maneras.
El calor, en conclusión, siempre va desde los cuerpos de mayor temperatura a los de menor. Tu taza de café nunca se va a calentar si la dejas tranquila sobre la mesa sin ningún otro aporte de energía. Y, en general, todas las transformaciones que ocurren por sí solas en el Universo tienden a desordenarlo un poco más. Todo lo que veas ordenado (un castillo de naipes, tu habitación, una molécula de azúcar o la estructura celular de tu cerebro) ha requerido aportes de energía para construirse y mantenerse, hasta el punto que puede parecer que los seres vivos violamos la segunda ley de la termodinámica.
Quedan otras dos leyes por enunciar. El principio cero (que fue el último de todos en enunciarse) parte de la comparación entre caliente y frío y es importante para la construcción de escalas y herramientas para medir la temperatura. Si dos cuerpos están en equilibrio térmico con un tercer cuerpo, entonces los dos primeros están también en equilibrio térmico entre sí (es decir, su temperatura es la misma). Puede parecer una obviedad, pero esta es la razón por la que nuestra piel no es un buen termómetro: sólo detectamos como caliente algo que esté a una mayor temperatura que la parte del cuerpo con la que lo estamos tocando y frío algo que esté a una temperatura menor. Basta que tengamos una mano caliente y la otra mano fría para no saber qué sensación nos produce un objeto templado que toquemos con ambas a la vez (prueba a hacer el experimento con tres cuencos de agua a diferentes temperaturas).
La tercera ley de la termodinámica marca un tope de temperatura por debajo de la cual no se puede bajar, el cero absoluto (unos -273,15 ºC), incapaz de alcanzarse, ya que significaría el reposo total de las moléculas y los átomos, la carencia total de energía en un cuerpo. En condiciones experimentales se ha estado bastante cerca de alcanzar a esta temperatura, pero nunca se ha llegado, ni se llegará ni se bajará de ella.
Las leyes de la termodinámica son omnipresentes y rigen tanto nuestro desayuno como la vida (y muerte) de las estrellas; ninguna reacción química sucede si es termodinámicamente desfavorable, y si ocurre es porque está recibiendo un préstamo de energía para suceder. Es el caso de la fotosíntesis, por la que las plantas ordenan el dióxido de carbono en grandes moléculas de azúcar aprovechando la energía que les aporta la luz del Sol.
Disfruta, friolero desordenado, de tu café caliente por las mañanas y del caótico carnaval que es el Universo en el que te ha tocado vivir, en el que unas cosas suceden solas y otras no, bajo las siguientes reglas: la energía no se crea ni se destruye, se pierde siempre en cierta medida en forma de calor en todos los trabajos y fluye espontáneamente hasta poner a la misma temperatura los cuerpos calientes y los fríos, que nunca se enfrían del todo.