El ozono es un gas que podemos encontrar en la atmósfera. Se trata de la combinación de 3 átomos de oxígeno, y a diferencia del oxígeno atmosférico (O2) tiene un color azulado y huele. Se forma por efecto de las radiaciones del sol al incidir sobre los átomos de oxígeno, también por campos electromagnéticos de tormentas eléctricas y se distribuyen por la estratosfera, formando una capa, llamada capa de ozono.

Estado alotrópico del oxígeno, que se forma de manera natural en la atmósfera por las descargas eléctricas producidas durante las tormentas; es muy oxidante y se utiliza, entre otros usos, como índice de contaminación atmosférica (O3).
Un estado alotrópico es un diferente estado de un mismo elemento, es decir, el átomo de oxígeno puede presentarse como oxígeno atmosférico u ozono, según se combinan dos o tres átomos de oxígeno.
El ozono se produce cuando las radiaciones UV rompen el oxígeno atmosférico, que se encuentra en las capas altas de la atmósfera, en átomos de oxígeno cuando reciben una cantidad determinada de ésta; estos átomos de oxígeno se unen a moléculas de oxígeno para formar la molécula de ozono. Esta reacción se encuentra en equilibrio entre el oxígeno atmosférico y el ozono. Después cuando el sol no incide el ozono se combina con un átomo de oxígeno para formar 2 moléculas de oxígeno atmosférico. Este equilibrio es importante para que se mantenga la capa de ozono, y algunos compuestos derivados de las actividades humanas pueden afectarlo (compuestos clorados, clorofluorocarbonos, y los compuestos bromurados).
¿Qué es la capa de ozono y a qué altura se encuentra?
Es la capa donde se concentra el ozono atmosférico, de espesor variable y situada entre 10 y 50 km de altura, que es de gran importancia biológica porque filtra la radiación ultravioleta.
La capa de ozono también se denomina ozonosfera, y es una zona de la estratosfera donde la concentración de este gas es relativamente alta. Se sitúa entre los 15 km de altitud y los 50km, y aquí se encuentra el 90% del ozono de la atmósfera.
Te recomendamos ver la animación sobre las diferentes capas de la atmósfera.
¿Quién descubrió la capa de ozono? Se descubrió en 1913 por los físicos Charles Fabry y Henri Buisson. Más tarde el meteorólogo Gordon Miller Bourne Dobson fabricó un espectrofotómetro sencillo que desde la tierra podía medir el ozono estratosférico. Entre 1928 y 1958 se estableció una red mundial de monitoreo de ozono, y en su honor se nombró la unidad Dobson (DU), usándose como unidad de medida del espesor de la capa de ozono. 1DU corresponde a 0,01 mm de espesor de ozono en condiciones normales de presión y temperatura (1 atm y 0ºC), es decir, 2.69 × 1016 moléculas por centímetro cuadrado.
¿Cuál es su función?
La capa de ozono absorbe entre el 97 y el 99 % de la radiación ultravioleta de baja frecuencia (150-300 nm). La variación de la capa de ozono produce un efecto importante sobre la superficie terrestre, es decir, una capa de ozono de unas 300 DU (3 mm) haría que la superficie de la tierra estuviera a 0º C.
¿Por qué el ozono absorbe la radiación?
El ozono se crea principalmente por radiación ultravioleta. Cuando los rayos ultravioleta de alta energía golpean las moléculas de oxígeno ordinarias (O2), dividen la molécula en dos átomos de oxígeno individuales. Los átomos de oxígeno libres son altamente reactivos, por lo que es muy raro encontrarlos en la naturaleza, y, debido a que hay pocos átomos de oxígeno individuales libres, lo más probable es que se encuentren con una molécula de oxígeno, es decir, dos átomos de oxígeno unidos. Cuando se encuentran, reaccionan formando la molécula de ozono, con tres átomos de oxígeno.
Hay tanto oxígeno en nuestra atmósfera, que estos rayos ultravioleta de alta energía se absorben completamente en la estratosfera. Cuando una molécula de ozono absorbe radiación ultravioleta de baja energía, como mencionamos previamente, ésta se divide en una molécula de oxígeno ordinaria y un átomo de oxígeno libre. Por lo general, este átomo de oxígeno libre se vuelve a unir rápidamente con una molécula de oxígeno para formar otra molécula de ozono. Debido a este “ciclo de ozono-oxígeno“, la radiación ultravioleta dañina se convierte en calor y no llega hasta la troposfera donde podrían afectar a nuestra salud.
¿Por qué es tan importante para la vida en la tierra?
En 1987 se firmó el protocolo de Montreal en la Asamblea General de las Naciones Unidas, ya que el desgaste de esta capa que estaba en aumento es el causante de melanomas, cataratas oculares, cáncer de piel entre otras enfermedades, además la radiación ultravioleta afectará también a otros seres vivos.
Por tanto se llegó a la conclusión que había que suprimir el uso de compuestos químicos como los clorofluorocarbonos (CFC), (refrigerantes industriales, propelentes), y fungicidas de suelo (como el bromuro de metilo) que destruyen la capa de ozono a un ritmo 50 veces superior a los CFC.
¿Qué es el “agujero en la capa de ozono”?
Región de la atmósfera en la que se produce una disminución de la concentración de ozono, más pronunciada en la Antártida.
El agujero de la capa de ozono se produce debido a las condiciones atmosféricas y químicas especiales que existen en la Antártida y que no suceden en ninguna otra parte del planeta. Las temperaturas invernales muy bajas en la estratosfera antártica hacen que se formen nubes estratosféricas polares (PSC, polar stratospheric clouds). Las reacciones que se producen en las PSC, combinadas con el aislamiento relativo del aire estratosférico polar, permiten que las reacciones de cloro y bromo produzcan el agujero de ozono en la primavera antártica.
Las reacciones en las superficies de estas PSC provocan un aumento notable en el gas de cloro más reactivo, el monóxido de cloro (ClO). Las temperaturas estratosféricas son más bajas en ambas regiones polares en invierno. En el invierno antártico, las temperaturas diarias mínimas son generalmente mucho más bajas, alrededor de los -90ºC, y menos variables que en el invierno ártico, que se encuentran sobre los -80ºC. Además, las temperaturas antárticas también permanecen por debajo de la temperatura de formación de PSC durante períodos mucho más largos durante el invierno (unos 5 meses) y en el Ártico solo durante períodos limitados (10–60 días) en la mayoría de los inviernos.
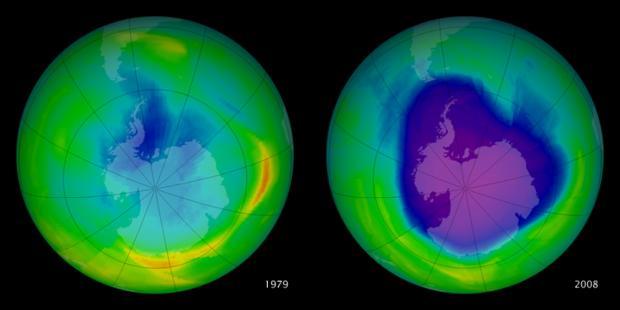
Comparación del agujero en la capa de ozono sobre la Antártida en 1979 y 2008. La densidad de ozono llegó a su mínimo en el año 2000 y a partir de entonces se ha ido recuperando. Los tonos azules y morados denotan las bajas densidades de ozono / Créditos de la imagen: NASA
Aparte, el aire estratosférico en las regiones polares está relativamente aislado de otras regiones estratosféricas durante largos períodos en los meses de invierno. El aislamiento se produce debido a los fuertes vientos que rodean los polos, formando un vórtice polar, que impide el movimiento sustancial de aire dentro o fuera de la estratosfera polar. Esta circulación se fortalece en invierno a medida que disminuyen las temperaturas estratosféricas y, por lo que comentamos previamente sobre la temperatura, esto resulta más efectivo en la Antártida que en el Ártico. Una vez que se producen cambios químicos en las regiones polares de las reacciones en las PSC, el aislamiento conserva esos cambios durante muchas semanas o meses.
Las PSC líquidas y sólidas pueden aumentar sustancialmente la abundancia de los gases de cloro más reactivos. Estas reacciones convierten las formas de reservorio de gases de cloro reactivos, como el nitrato de cloro (ClONO2) y cloruro de hidrógeno (HCl), en su forma más reactiva, el monóxido de cloro (ClO).
El tipo más común de PSC se forma a partir del ácido nítrico (HNO3) y el agua que se condensa en partículas preexistentes que contienen ácido sulfúrico líquido. Las partículas de PSC crecen lo suficientemente grandes y son lo suficientemente numerosas como para que se puedan observar características similares a las nubes desde el suelo en ciertas condiciones, particularmente cuando el Sol está cerca del horizonte.
Cuando las temperaturas promedio comienzan a aumentar a fines del invierno, las PSC se forman con menos frecuencia y sus reacciones de conversión de superficie producen menos monóxido de cloro. Sin una producción continua del monóxido de cloro, sus proporciones disminuyen y acaba volviendo a su forma de reservorios reactivos que comentamos antes.
Debido a que las PSC a menudo contienen una fracción significativa del HNO3 disponible, su descenso elimina el HNO3 de las regiones de la capa de ozono. Este proceso se llama desnitrificación de la estratosfera. Con menos HNO3, el gas de cloro altamente reactivo ClO permanece químicamente activo durante un período más largo, lo que aumenta la destrucción química del ozono.
¿Qué provoca que el agujero de la capa de ozono se haga más grande?
Debido a que los átomos de ozono y oxígeno libre son altamente inestables, reaccionan muy fácilmente con otros compuestos que se encuentran naturalmente en la atmósfera de la Tierra. Por ejemplo, naturalmente las erupciones volcánicas pueden inyectar materiales en la estratosfera que pueden conducir a una mayor destrucción del ozono, pero esto es algo que ocurre con una frecuencia muy baja.
A lo largo de la vida de la Tierra, los procesos naturales han regulado el equilibrio del ozono en la estratosfera. Sin embargo, uno de los primeros compuestos que demostraron romper la capa de ozono y que provenía de la actividad humana fueron unos productos químicos que liberaban cloro, como los clorofluorocarbonos (CFC). Estos compuestos se encontraban en productos como los aerosoles,
Para saber más…
Si tenéis interés en conocer otros compuestos que afectan al ozono podéis encontrarlos en la Agencia de Protección Ambiental de los Estados Unidos.
Debido a que son moléculas extremadamente estables, los CFC no reaccionan fácilmente con otros químicos en la troposfera, ya que están protegidos de la radiación ultravioleta por la propia capa de ozono. Una de las pocas fuerzas que pueden romper las moléculas de CFC es la radiación ultravioleta, y, como nada las detiene debido a ser tan estables, estas moléculas podían subir inalteradas hasta la estratosfera.
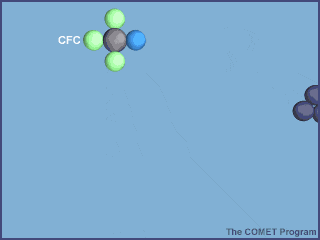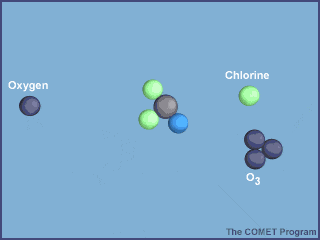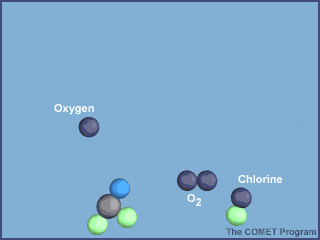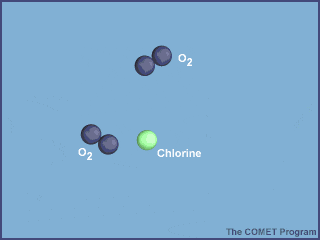
Esta animación muestra la destrucción de una molécula de ozono por un átomo de cloro. Créditos a UCAR / COMET.
Una vez en la estratosfera, las moléculas de CFC ya no están protegidas de la radiación ultravioleta por la capa de ozono, provocando que se rompan y liberen átomos de cloro. Los átomos de cloro libres también son muy reactivos, por lo que en cuanto encuentran a las moléculas de ozono, le “roban” un átomo de oxígeno, produciendo monóxido de cloro y una molécula de oxígeno; dos productos mucho más estables.
Pero claro, ¿cómo es que estos compuestos podrían siquiera acabar con toda la capa de ozono? Es cierto que si cada átomo de cloro liberado por una molécula de CFC destruyera solo una molécula de ozono, supondrían una amenaza muy pequeña. A pesar de esto, el problema reside en el momento en que la molécula de monóxido de cloro baja se encuentra con un átomo de oxígeno libre. Dado que la molécula de oxígeno es más estable que la de monóxido de cloro, la reacción va a estar desplazada hacia ese lado, es decir, lo más probable es que el átomo de oxígeno le “robe” el oxígeno al monóxido de cloro para formar una molécula de oxígeno, dejando al cloro libre de nuevo para seguir rompiendo moléculas de ozono.
Si tuviéramos que simplificarlo de algún modo, podríamos decir que el cloro se convierte en un catalizador de la reacción ozono a oxígeno, desplazando la reacción a la formación de oxígenos moleculares.
Por suerte, estos átomos de cloro no permanecen en la estratosfera para siempre, aunque hay algunos, como el CFC-115 (C2F5Cl) o cloropentafluoroetano, pueden permanecer más de 1000 años. Cuando un átomo de cloro libre altamente inestable se encuentra con el metano (CH4), le roba un hidrógeno y forma una molécula de cloruro de hidrógeno (HCl), que puede ser transportada hacia abajo desde la estratosfera a la troposfera, uniéndose al agua y cayendo con la lluvia. Pero antes de que esto ocurra, este átomo de cloro habrá roto 100.000 moléculas de ozono.
¿Se puede recuperar la capa de ozono?
Si los humanos dejásemos de enviar compuestos que provocan dicha destrucción, la capa de ozono eventualmente puede repararse a sí misma. Esto ocurriría porque el ciclo ozono-oxígeno que comentábamos al principio seguiría ocurriendo y poco a poco se iría reponiendo.
De hecho, desde la prohibición de los productos con estas propiedades en el Protocolo de Montreal de 1987, ha provocado una recuperación lenta pero constante de la capa de ozono. Las mediciones muestran que la disminución del cloro en la estratosfera ha resultado en una recuperación del 20% del ozono desde las mediciones del satélite Aura en 2005.
Dado que los CFC tienen vidas de entre 50 y 100 años (por lo general), se espera que la recuperación del agujero de ozono ocurra entre el año 2060 y el 2080, pero con todo y eso podría aún permanecer un pequeño agujero debido a los compuestos de duración superior.
Referencias bibliográficas:
- https://www.esrl.noaa.gov/csd/assessments/ozone/2010/twentyquestions/Q10.pdf
- https://www.epa.gov/ozone-layer-protection/ozone-depleting-substances
- https://agupubs.onlinelibrary.wiley.com/doi/abs/10.1002/2017GL074830
 Proyecto Dodociencia es un proyecto por Hidden Nature está bajo licencia internacional Creative Commons Reconocimiento - No Comercial - CompartirIgual 4.0. Creado bajo el proyecto Hidden Nature. Puede encontrar permisos adicionales de los concedidos con esta licencia en nuestras políticas de privacidad
Proyecto Dodociencia es un proyecto por Hidden Nature está bajo licencia internacional Creative Commons Reconocimiento - No Comercial - CompartirIgual 4.0. Creado bajo el proyecto Hidden Nature. Puede encontrar permisos adicionales de los concedidos con esta licencia en nuestras políticas de privacidad