Debemos tener presente que las drogas o medicamentos se administran a grupos heterogéneos de individuos. Dentro de este grupo de individuos, encontraremos subgrupos que respondan de manera adecuada a dicho tratamiento (es decir, mejoran con la administración de un determinado fármaco) y subconjuntos que no lo hagan (el tratamiento les es indiferente o les resulta dañino). Es más, en ocasiones oímos que determinados fármacos se han retirado del mercado o que determinada investigación ha resultado en la obtención de un determinado fármaco que luego nunca vemos en las farmacias. ¿Por qué? La respuesta radica en la toxicidad que puede generar dicho fármaco a una parte de la población. Un riesgo inasumible para la industria farmacéutica.
Ante esta situación, y gracias a la aplicación de herramientas “ómicas” al estudio de la farmacología y farmacocinética, podemos tener un patrón genético que nos permita diferenciar grupos de pacientes y crear “fármacos a medida”. Esta situación ha generado un nuevo campo de estudio que la ciencia ha denominado farmacogenómica. Y esta disciplina, como no podía ser de otra forma, tiene un aliado fundamental en el estudio de los biomarcadores.
Podemos definir la farmacogenómica como aquella disciplina científica que estudia las bases moleculares y genéticas de las enfermedades con el objetivo de desarrollar nuevos tratamientos más efectivos y seguros adaptados a la caracterización genética de cada individuo. Para ello, centran sus estudios en la búsqueda de biomarcadores que pudieran estar presentes en el ADN (polimorfismo génico), ARNm (patrón de expresión), proteoma, metaboloma, etc., así como el efecto de todos ellos en la respuesta a los fármacos.
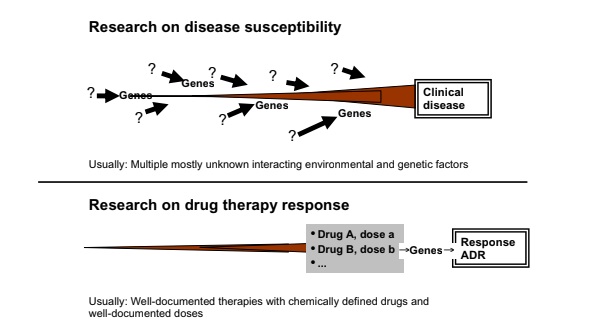
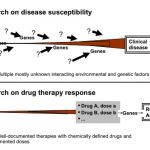
Diferencias entre los estudios farmacogenómicos sobre la susceptibilidad a la enfermedad (mitad superior de la imagen) y la respuesta a un determinado fármaco (mitad inferior de la imagen). En la patogénesis de las enfermedades, múltiples factores (de carácter endógeno, exógeno o de ambos tipos) interactúan con uno o numerosos genes.En los estudios de farmacoterapia, a pesar de conocer las drogas y dosis administradas al paciente, pueden aparecer genes polimórficos que acaben desarrollando una reacción adversa al medicamento en cuestión.
No obstante, numerosas voces autorizadas en el ámbito científico aseguran que “aunque necesaria”, la farmacogenómica resulta insuficiente, ya que en el mismo escenario intervienen otros actores que, aún desempeñando un papel, antojan difícilmente cuantificables o mensurables. Entre ellos podemos destacar como ejemplo la dieta; el estado de salud del individuo; el medio ambiente; la etnia; etc. Asimismo, durante el estudio de los biomarcadores y los diferentes ensayos clínicos cabe la posibilidad de que no todos los genotipos estén incluidos y sólo se encuentren aquellos que tienen una mayor representación en la población, dando lugar a lo que se conoce como “genotipos huérfanos”, pacientes para cuyos genotipos, dada su “rareza”, no existe fármaco específico o no resulta “rentable” invertir en su desarrollo (la investigación no busca rentabilidad sino optimizar recursos, que a menudo se antojan escasos), dada la baja prevalencia del genotipo entre la población mundial.
Un genotipo huérfano pudiera corresponder, por ejemplo, a aquellos pacientes asmáticos que presentan el promotor ALOX5 (araquidonato 5-lipoxigenasa), los cuales muestran una respuesta nula ante el tratamiento asmático convencional. Puesto que hasta la fecha no parece existir un tratamiento alternativo, es tarea de la farmacogenómica trabajar para dotar de soluciones factibles a estos asmáticos.
No obstante, conocemos más casos de polimorfismo génico que han sido y están siendo ampliamente estudiados por la farmacogenómica, como el de la enzima glucosa-6-fosfato deshidrogenasa (G6PDH).
Durante los conflictos bélicos en los que EE.UU. participó a lo largo del siglo pasado, las tropas americanas eran tratadas frecuentemente con el antimalárico primaquina, un fármaco del grupo de las 8-aminoquinolinas. Al serle administrado a los soldados, se observó que un elevado número de soldados de origen afroamericano sufrían hemólisis durante el tratamiento, algo que no ocurría entre los soldados de “raza blanca”. Los estudios llegaron a determinar que la primaquina no actúa de igual manera entre los individuos africanos (o de ascendencia africana) que entre los caucásicos, con lo que establecieron qué fármaco antimalárico debería administrarse según la zona del mundo donde fuese necesario actuar. La farmacogenómica estableció que la hemólisis después de administrar primaquina como agente antimalárico es muy rara en las poblaciones caucásicas del norte de Europa, pero el 10% de la población africana y mediterránea sí la muestra. ¿Y a dónde nos lleva esta conclusión? A que estas diferencias interétnicas hacen que cada empresa interesada en la comercialización a nivel mundial de diferentes fármacos desarrolle estudios farmacogenéticos para conocer las diferencias interétnicas, caracterizar los genes relevantes en dicho fenómeno y ajustar así la farmacodinamia según el paciente. La farmacogenómica permite que cada vez encontremos medicamentos más seguros y con menos efectos adversos o secundarios en nuestros dispensarios.
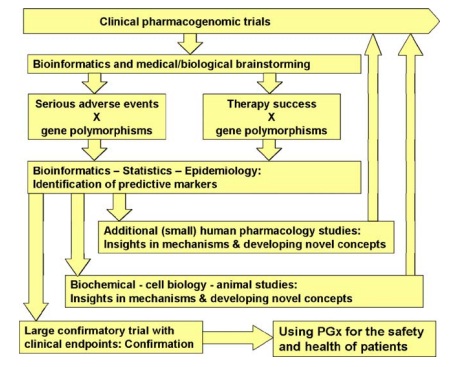
Etapas y rutas que sigue la investigación farmacogenómica. Las rutas aquí mostradas no son únicas, ya que los diferentes enfoques pueden combinarse (enfoque multidisciplinar) para obtener conocimientos farmacogenómicos valiosos que permitan desarrollar nuevas terapias o mejorar las ya existentes.
Gracias a los estudios farmacogenéticos, los científicos conocen hoy día más de 150 mutaciones que causan deficiencia G6PDH, y simplemente basta con realizar un simple estudio de la actividad enzimática en los glóbulos rojos para detectarlo. No obstante, las variantes genéticas G6PDH siguen suponiendo un reto para la lucha contra la malaria, y es que, a pesar de que estos pacientes están protegidos contra la enfermedad (conocemos los riesgos de hemólisis inducida en caso de administrar primaquina), el mapa de incidencia de la enfermedad se solapa con las zonas de mayor prevalencia de G6PDH deficiente como consecuencia de las mutaciones anteriormente comentadas..
En la actualidad, los investigadores pueden evaluar con un “coste asumible” la expresión de más de 1.000.000 de poliformismos en nuestra genoma, lo que supone un número extraordinariamente elevado, habida cuenta que la farmacogenómica es una disciplina naciente y que se estima que en nuestro organismo albergamos aproximadamente unos 20.000 genes diferentes.
Como pueden observar, el estudio de los biomarcadores en farmacogenómica ayuda no sólo a comprender por qué los fármacos no actúan de la misma manera en todos los pacientes, sino que, además, permite elaborar fármacos a medida, más eficientes y eficaces, permitiendo eliminar o limitar los efectos secundarios.